四川省成都市龙泉驿区第一中学校2016-2017学年高一化学12月月考
四川省成都市龙泉驿区第一中学校2016-2017学年高一化学12月月考试题
(时间:90分钟 满分100分)
可能用到的相对原子质量:H 1 O 16 Na 23 C 12 Al 27 Mg24 Br 80 Ba 137
第I卷 选择题(共44分)
一、 选择题(共22小题,每小题2分,共44分,每小题只有一个正确选项)
1.将金属钠放在燃烧匙中加热使其燃烧,不可能出现的现象是( )
A.金属钠融化为小球 B.火焰为黄色
C.燃烧后得到一白色固体 D.燃烧后得到一淡黄色固体
2.同温同压下,两种气体的体积如果不相同,请你推测其主要原因是
A.气体的分子大小不同 B.气体分子的物质的量不同
C.气体分子的化学性质不同 D.气体分子间的平均距离不同
3、奥运会开幕式上的焰火“脚印”、“笑脸”、“五环”让奥运会更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是( )
A.焰色反应均应透过蓝色钴玻璃观察 B.NaC1与Na2CO3灼烧时火焰颜色相同
C.焰色反应是化学变化 D.所有金属及其化合物灼烧时火焰均有颜色
4、下列说法错误的是( )
A.钠在空气中燃烧时先熔化,再燃烧,最后所得产物只有Na2O
B.铝在空气中形成了一薄层致密的氧化膜,保护了里面的铝,故铝不需要像钠似的保护
C.铝制品在生活中非常普遍,这是因为铝不活泼
D.铁在潮湿的空气中生成的氧化物疏松,不能保护内存金属,故铁制品往往需涂保护层
5、合金与纯金属制成的金属材料相比,优点是( )
①合金的硬度一般比它的各成分金属的大; ②一般地,合金的熔点比它的各成分金属的低; ③改变原料和原料的配比、改变生成合金的工艺,可以得到具有不同性能的合金; ④合金比纯金属的导电性能更强; ⑤合金比纯金属的应用范围更广泛。
A.②③④ B.①②③⑤
C.①②④ D.①②④⑤
6、用NA表示阿伏加德罗常数,下列说法中正确的是
A.23g钠与氧气完全反应生成氧化钠和过氧化钠,转移的电子数目为1.5NA
B.2 L 0.1 mol•L-1 偏铝酸钠溶液中溶质离子总数为0.8NA
C.5.6 g铁与足量盐酸反应转移的电子数为0.2NA
D.在常温常压下,11.2 L氯气所含的原子数目为NA
7.某无色透明呈强碱性溶液中能大量共存的离子组是
A.Na+ Cu2+ NO Cl— B.K+ NO Na+ Cl—
C.K+ CO NO Ca2+ D.K+ NO SO Mg2+
8.下列反应的离子方程式正确的是
A.铁粉加入三氯化铁溶液 Fe+ Fe3+ =2 Fe2+
B.澄清的石灰水与盐酸反应:H++OH—=H2O
C.碳酸钡加入稀硫酸:BaCO3+2H+=Ba2++H2O+CO2↓
D.碳酸钠与盐酸等物质的量反应:CO +2H+=H2O+CO2↑
9. 在5NaBr+NaBrO3+3H2SO4=3Br+3Na2SO4+3H2O中被氧化的溴原子和被还原的溴原子个数比为
A. 5∶1 B.1∶5 C.6∶1 D.1∶6
10.比较是化学学习中的一种重要方法。下列各组比较中错误的是
A.在相同温度下的溶解度:Na2CO3> NaHCO3
B.热稳定性:Na2CO3> NaHCO3> H2CO3
C.表示Na2CO3和NaHCO3分别与盐酸反应的离子方程式相同
D.等质量的Na2CO3和NaHCO3分别与等浓度的HCl溶液完全反应,后者消耗的盐酸少
11. 有五种化合物:①Mg(HCO3)2,②Al(OH)3,③Al,④(NH4)2CO3,⑤Al2O3.跟盐酸和NaOH溶液都能反应的物质有( )
A.二种 B.三种 C.四种 D.五种
12.相同质量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生气体的体积比是(相同条件下)( )
A.1:1 B.2:3 C.3:2 D.1:2
13.根据下列反应方程式,判断指定的四种物质的氧化性由强到弱的顺序正确的是
(1)Cl2+2KI=2KCl+I2 (2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2H I=2FeCl2+2HCl+I2 (4)H2S+I2=2HI+S
A.S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>S
C.Fe3+>Cl2>S>I2 D.Cl2>I2>Fe3+>S
14.下列说法正确的是
A.氧气的摩尔质量是16g B.1molOH-的质量是17g.mol-
C.以克为单位,氩气的摩尔质量在数值上等于它的相对原子质量
D.1mol氢气分子的质量是1g
15. 下列有关叙述正确的是
A.配制一定物质的量浓度的溶液和萃取实验前,都必须检验所用仪器是否漏水
B.将4 g NaOH溶入准确量取的100 mL水中,可制得浓度为1 mol/L的NaOH溶液
C.如果不慎将稀盐酸沾到皮肤上,应先用NaOH溶液涂抹,再用水冲洗
D.最好用蒸馏的方法分离出CCl4和水的混合物
16.用0.1m ol∕L Na2SO3溶液30 ml,恰好将2×10-3 mol的XO4-离子还原,则元素X在还原产物中化合价是
A.+1 B.+2 C.+3 D.+4
17. 将Na2O2投入下列溶液中, 可观察到的现象是( )
A.投入水中无明显变化 B.投入FeCl3溶液中生成红褐色沉淀
C.投入紫色石蕊试液中溶液先变红后褪色 D.投入碳酸氢钠溶液中产生CO2
18.下列带括号的气体在反应中只做氧化剂的是
A.2F2 (g)+2H2O=4HF+O2↑ B.SO2 (g)+I2+2H2O=H2SO4+2HI
C.H2S(g)+Br2=2HBr+S ↓ D.3NO2(g)+H2O=2HNO3+NO
19.某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是
A.所用NaOH已经潮解
B.称量氢氧化钠时指针偏向右边
C.向容量瓶中加水未到刻度线
D.用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法
20.现有两瓶失去标签的Na2CO3和NaHCO3无色的饱和 溶液,请提出简便的鉴别方法,其中不合理的是( )
①用干燥的pH试纸检验,pH大的是Na2CO3
②取同量的溶液于两支试管中,各滴入酚酞试液,红色较深的是Na2CO3
③取同量的溶液于两支试管中,加热,有气泡产生的是NaHCO3
④取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3
⑤取同量 的溶液于两支试管中,滴加BaCl2溶液,生成白色沉淀的是Na2CO3
⑥取同量的溶液于两支试管中,滴加澄清石灰水,,生成白色沉淀的是Na2CO3
A.①② B.③⑥ C.④⑤ D.②⑤
21.向a mL0.25mol•L-1的AlCl3溶液中加入金属钠,反应完全后,恰好只形成NaCl和NaAlO2的混合溶液,则加入金 属钠的物质的量为( )
A.2.5a×10-4mol B.a×10-3mol C.7.5a×10-4mol D.a×10-4mol
22. 准确称取6.0 g铝土矿样品(含Fe2O3),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol•L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )
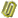 |
|
(时间:90分钟 满分100分)
可能用到的相对原子质量:H 1 O 16 Na 23 C 12 Al 27 Mg24 Br 80 Ba 137
第I卷 选择题(共44分)
一、 选择题(共22小题,每小题2分,共44分,每小题只有一个正确选项)
1.将金属钠放在燃烧匙中加热使其燃烧,不可能出现的现象是( )
A.金属钠融化为小球 B.火焰为黄色
C.燃烧后得到一白色固体 D.燃烧后得到一淡黄色固体
2.同温同压下,两种气体的体积如果不相同,请你推测其主要原因是
A.气体的分子大小不同 B.气体分子的物质的量不同
C.气体分子的化学性质不同 D.气体分子间的平均距离不同
3、奥运会开幕式上的焰火“脚印”、“笑脸”、“五环”让奥运会更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是( )
A.焰色反应均应透过蓝色钴玻璃观察 B.NaC1与Na2CO3灼烧时火焰颜色相同
C.焰色反应是化学变化 D.所有金属及其化合物灼烧时火焰均有颜色
4、下列说法错误的是( )
A.钠在空气中燃烧时先熔化,再燃烧,最后所得产物只有Na2O
B.铝在空气中形成了一薄层致密的氧化膜,保护了里面的铝,故铝不需要像钠似的保护
C.铝制品在生活中非常普遍,这是因为铝不活泼
D.铁在潮湿的空气中生成的氧化物疏松,不能保护内存金属,故铁制品往往需涂保护层
5、合金与纯金属制成的金属材料相比,优点是( )
①合金的硬度一般比它的各成分金属的大; ②一般地,合金的熔点比它的各成分金属的低; ③改变原料和原料的配比、改变生成合金的工艺,可以得到具有不同性能的合金; ④合金比纯金属的导电性能更强; ⑤合金比纯金属的应用范围更广泛。
A.②③④ B.①②③⑤
C.①②④ D.①②④⑤
6、用NA表示阿伏加德罗常数,下列说法中正确的是
A.23g钠与氧气完全反应生成氧化钠和过氧化钠,转移的电子数目为1.5NA
B.2 L 0.1 mol•L-1 偏铝酸钠溶液中溶质离子总数为0.8NA
C.5.6 g铁与足量盐酸反应转移的电子数为0.2NA
D.在常温常压下,11.2 L氯气所含的原子数目为NA
7.某无色透明呈强碱性溶液中能大量共存的离子组是
A.Na+ Cu2+ NO Cl— B.K+ NO Na+ Cl—
C.K+ CO NO Ca2+ D.K+ NO SO Mg2+
8.下列反应的离子方程式正确的是
A.铁粉加入三氯化铁溶液 Fe+ Fe3+ =2 Fe2+
B.澄清的石灰水与盐酸反应:H++OH—=H2O
C.碳酸钡加入稀硫酸:BaCO3+2H+=Ba2++H2O+CO2↓
D.碳酸钠与盐酸等物质的量反应:CO +2H+=H2O+CO2↑
9. 在5NaBr+NaBrO3+3H2SO4=3Br+3Na2SO4+3H2O中被氧化的溴原子和被还原的溴原子个数比为
A. 5∶1 B.1∶5 C.6∶1 D.1∶6
10.比较是化学学习中的一种重要方法。下列各组比较中错误的是
A.在相同温度下的溶解度:Na2CO3> NaHCO3
B.热稳定性:Na2CO3> NaHCO3> H2CO3
C.表示Na2CO3和NaHCO3分别与盐酸反应的离子方程式相同
D.等质量的Na2CO3和NaHCO3分别与等浓度的HCl溶液完全反应,后者消耗的盐酸少
11. 有五种化合物:①Mg(HCO3)2,②Al(OH)3,③Al,④(NH4)2CO3,⑤Al2O3.跟盐酸和NaOH溶液都能反应的物质有( )
A.二种 B.三种 C.四种 D.五种
12.相同质量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生气体的体积比是(相同条件下)( )
A.1:1 B.2:3 C.3:2 D.1:2
13.根据下列反应方程式,判断指定的四种物质的氧化性由强到弱的顺序正确的是
(1)Cl2+2KI=2KCl+I2 (2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2H I=2FeCl2+2HCl+I2 (4)H2S+I2=2HI+S
A.S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>S
C.Fe3+>Cl2>S>I2 D.Cl2>I2>Fe3+>S
14.下列说法正确的是
A.氧气的摩尔质量是16g B.1molOH-的质量是17g.mol-
C.以克为单位,氩气的摩尔质量在数值上等于它的相对原子质量
D.1mol氢气分子的质量是1g
15. 下列有关叙述正确的是
A.配制一定物质的量浓度的溶液和萃取实验前,都必须检验所用仪器是否漏水
B.将4 g NaOH溶入准确量取的100 mL水中,可制得浓度为1 mol/L的NaOH溶液
C.如果不慎将稀盐酸沾到皮肤上,应先用NaOH溶液涂抹,再用水冲洗
D.最好用蒸馏的方法分离出CCl4和水的混合物
16.用0.1m ol∕L Na2SO3溶液30 ml,恰好将2×10-3 mol的XO4-离子还原,则元素X在还原产物中化合价是
A.+1 B.+2 C.+3 D.+4
17. 将Na2O2投入下列溶液中, 可观察到的现象是( )
A.投入水中无明显变化 B.投入FeCl3溶液中生成红褐色沉淀
C.投入紫色石蕊试液中溶液先变红后褪色 D.投入碳酸氢钠溶液中产生CO2
18.下列带括号的气体在反应中只做氧化剂的是
A.2F2 (g)+2H2O=4HF+O2↑ B.SO2 (g)+I2+2H2O=H2SO4+2HI
C.H2S(g)+Br2=2HBr+S ↓ D.3NO2(g)+H2O=2HNO3+NO
19.某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是
A.所用NaOH已经潮解
B.称量氢氧化钠时指针偏向右边
C.向容量瓶中加水未到刻度线
D.用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法
20.现有两瓶失去标签的Na2CO3和NaHCO3无色的饱和 溶液,请提出简便的鉴别方法,其中不合理的是( )
①用干燥的pH试纸检验,pH大的是Na2CO3
②取同量的溶液于两支试管中,各滴入酚酞试液,红色较深的是Na2CO3
③取同量的溶液于两支试管中,加热,有气泡产生的是NaHCO3
④取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3
⑤取同量 的溶液于两支试管中,滴加BaCl2溶液,生成白色沉淀的是Na2CO3
⑥取同量的溶液于两支试管中,滴加澄清石灰水,,生成白色沉淀的是Na2CO3
A.①② B.③⑥ C.④⑤ D.②⑤
21.向a mL0.25mol•L-1的AlCl3溶液中加入金属钠,反应完全后,恰好只形成NaCl和NaAlO2的混合溶液,则加入金 属钠的物质的量为( )
A.2.5a×10-4mol B.a×10-3mol C.7.5a×10-4mol D.a×10-4mol
22. 准确称取6.0 g铝土矿样品(含Fe2O3),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol•L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )




